双链核酸的特异性识别是生命科学领域的核心技术,然而该方法的序列局限性以及脱靶效应长期困扰分子诊断、病理成像等关键生物医学技术。尽管美国科学家发现的CRISPR及其核酸系统目前被广泛使用,但其对特定基序的依赖性以及脱靶效应不仅限制了其应用范围,且影响了其生物安全性。目前,各国学者在改进CRISPR及其核酸酶方面展开激烈竞赛,但尚未有新技术能完全解决这一问题。
2024年9月18日,我室苏昕教授课题组在《Nature Biotechnology》发表了题为“Bacteriophage λ exonuclease and a 5′-phosphorylated DNA guide allow PAM-independent targeting of double-stranded nucleic acids”的研究论文以及“Targeting double-stranded nucleic acids using the λ Exo-pDNA system”的研究简报,报道了一种来自噬菌体λ外切酶(λ Exo)的新特性,它可以在引导DNA的帮助下特异性靶向双链核酸序列,解决了现有技术的序列限制性与脱靶效应。
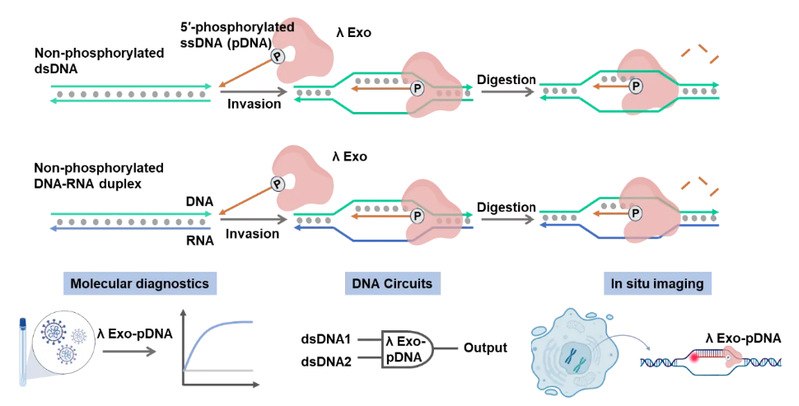
图λ Exo靶向双链核酸并切割pDNA的原理图;λ Exo的新特性应用于分子诊断、DNA电路和原位基因成像
本文通过单分子FRET (smFRET)分析证明了λ Exo在5'-磷酸化单链DNA(pDNA)的引导下能结合到含有pDNA互补区域的双链DNA(dsDNA)或DNA-RNA duplex的机制。这种结合作用可在室温或体温环境下实现,且不需要任何如PAM样的特定基序。在结合后,λ Exo在Mg2+的存在下将pDNA消化成核苷酸。利用这一特性,λ Exo-pDNA系统能够在室温和体温环境中探测双链基因及单核苷酸突变,还可以进行逻辑运算与信号放大。λ Exo- pDNA还可以用于基因组位点的原位荧光成像。λ Exo-pDNA系统在靶标范围、常温操作和序列特异性等方面,相较于现有的工具如TALEN、PfAgo 和 CRISPR-Cas有了显著提升。λ Exo-pDNA系统或将成为分子诊断、DNA计算和原位成像等领域的下一代工具。
论文的通讯作者为有机无机复合材料国家重点实验室苏昕教授,第一作者是生命科学与技术学院博士生付胜男。北京化工大学为论文的唯一单位。
原文链接:https://www.nature.com/articles/s41587-024-02388-9
简报链接:https://www.nature.com/articles/s41587-024-02409-7
苏昕教授简介:
北京化工大学有机无机复合材料国家重点实验室教授,博导,国家级青年人才。2015年在北京大学获得博士学位,曾在美国密歇根大学交流学习。2021年起任北京化工大学教授,博士生导师。主要研究方向包括:体外诊断、生物传感、生物纳米技术等。主持国家级人才项目1项,国家自然科学基金3项,国家重点研发课题2项,北京市自然科学基金1项。在Nature Biotechnology(2篇)、ACS Nano、Nano Letters(2篇)、Adv Func Mater、Nano Today上以第一或通讯作者发表论文50余篇,获国家发明专利5项。担任中国中西医结合学会检验医学专业委员会专家委员,Exploration期刊青年编委。曾获北京市优秀人才,中国仪器仪表学会朱良漪奖等。
