近日,我室刘惠玉教授团队与生命学院苏昕副教授合作,借助分子对接技术,理性设计了一种基于DNA框架的杂化纳米材料,并通过共递送小分子药物阿霉素(DOX)和反义寡核苷酸(ASO)G3139,实现了对实体瘤生长的有效抑制。相关成果发表于Small(DOI: 10.1002/**ll.202002578),苏昕副教授和刘惠玉教授为本文的通讯作者。
工程化DNA框架是一种可用于药物递送的亲和支架材料,多种抗癌分子如DOX和反义核酸药物(ASO)等均被证实可负载在其骨架上,从而提升治疗效果。然而,如何理性设计DNA框架材料以全面提高其稳定性、内化动力学和载药效率仍然是现阶段的一个挑战。近年来发展起来的DNA杂化材料为我们提供了一定的思路。阳离子聚合物是一种带有天然正电荷或阳离子单元的聚合物材料,其可以和一些带负电性生物分子如核酸等结合,形成聚电解质复合物,进而避免生物分子被体内酶降解,并促进内化和内体逃逸过程。此外,共轭聚合物是一类含有π-共轭结构单元的高分子,得益于其优异的光捕获和光放大能力,共轭聚合物已被广泛应用于体内外荧光成像。因此,将共轭阳离子聚合物(CCP)与DNA框架材料结合,有望改善DNA框架材料稳定性不足、药物递送效率低等问题。
分子对接是一种颇具应用前景的可用于指导药物载体设计的工具。基于此,研究团队借助分子对接技术理性设计了一种基于DNA框架的杂化纳米材料,其中,DNA框架作为模板以支撑CCP。所设计的材料主要有以下特点:1)由于DNA与CCP间的多重相互作用,杂化材料在生理状态条件下中表现出高度的稳定性;2)DNA杂化材料包含可携带DOX的独特口袋结构,具有比传统DNA上DOX结合位点更低的结合能,其提升的DOX结合亲和力使其具有较高的药物负载效率,并有效防止药物泄露;3)利用适配体对材料进行功能化后,共递送DOX和ASO药物G3139,可有效抑制肿瘤生长,并保证良好的生物安全性。该研究团队的工作有望为DNA杂化材料的设计与应用以及智能药物递送提供理论指导意义。
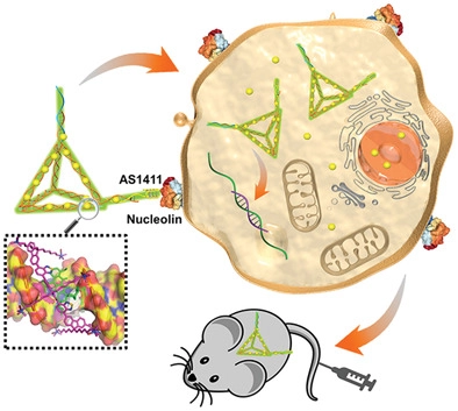
图1. DNA杂化纳米材料治疗示意图
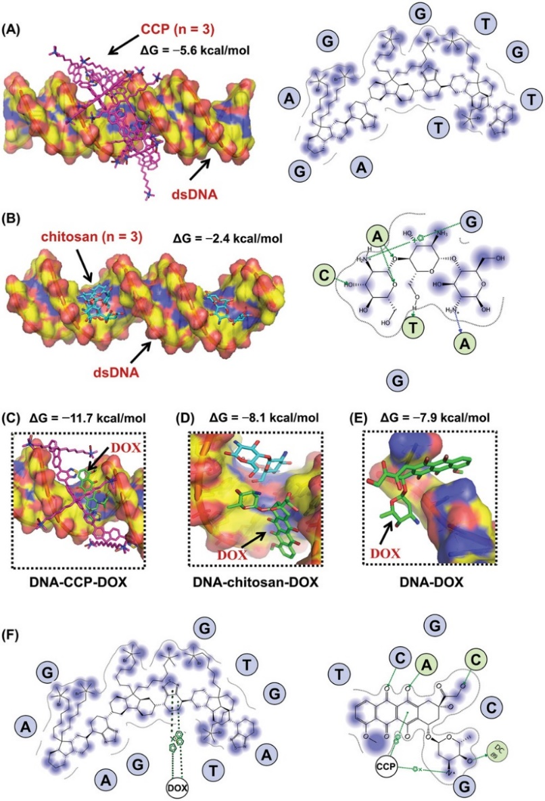
图2. 分子对接技术用于指导药物载体设计
要点:通过分子对接,发现在DNA主要沟槽处的共轭聚合物的特殊结构使小分子药物阿霉素(DOX)产生了一个独特的口袋,其结合能比传统的DOX结合位点要低。
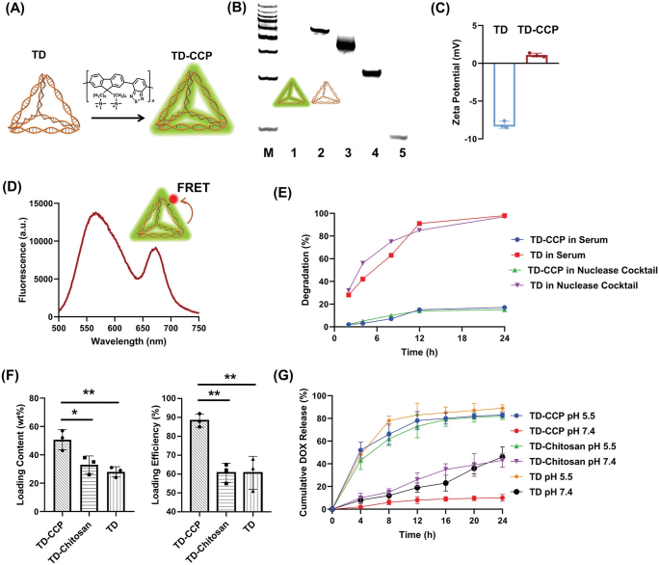
图3.DNA杂化纳米材料体外表征实验
要点:DNA与CCP共组装形成DNA杂化纳米材料TD-CCP,该材料在血清、核酸酶混合物等介质中均保持了良好的稳定性。同时,TD-CCP具备良好的DOX负载效率和pH响应药物释放能力。
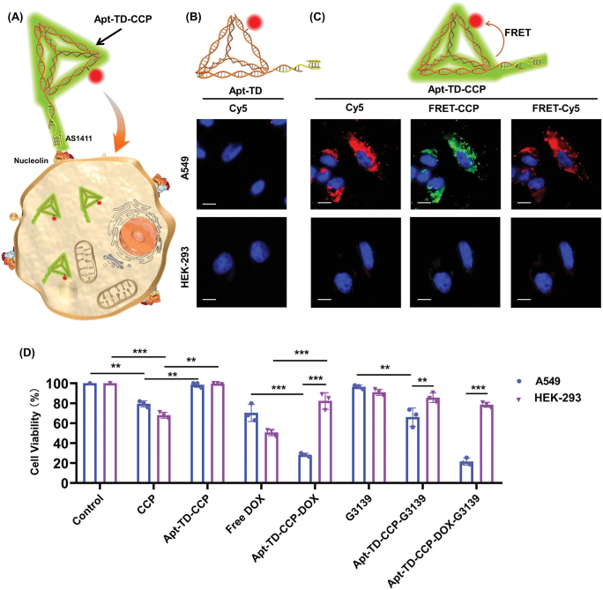
图4. 细胞摄取及药物递送表征
要点:TD-CCP在体液中表现出高度的稳定性和快速的细胞摄取能力,并保留了CCP的优良荧光特性。细胞实验中,Apt-TD-CCP-DOX对肿瘤细胞A549的细胞毒性比游离DOX高2.7倍,同时对正常细胞不表现出明显的毒性。
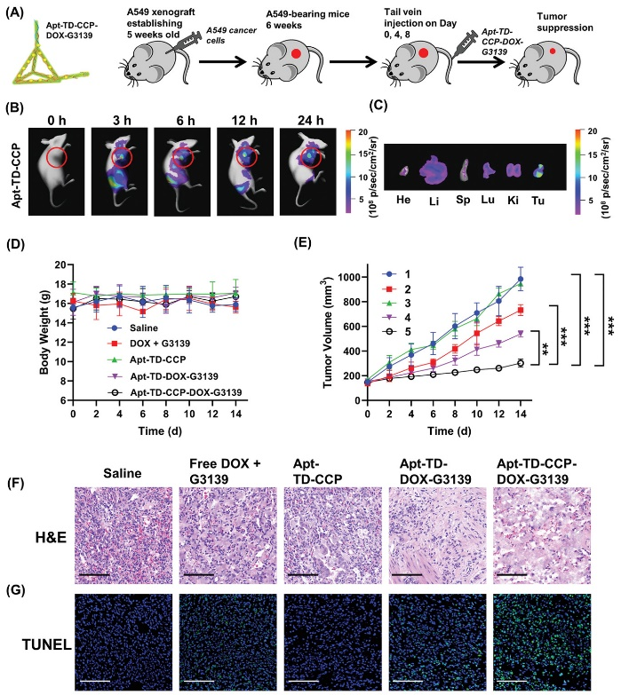
图5. 体内抗肿瘤效果评估
要点:通过共递送DOX和ASO药物G3139,Apt-TD-CCP-DOX-G3139可有效抑制实体瘤生长。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/**ll.202002578
刘惠玉课题组网页:http://www.liuhuiyugroup.com
