近日,我室刘惠玉教授和生命学院申鹤云副教授合作,构建了一种可降解纳米复合物,其可以在近红外光加速的基质金属蛋白酶9反应下生物降解为具有细胞组织双重渗透能力的小纳米颗粒,并具有光热和光动力性能可用于光声成像引导的协同化疗-光热肿瘤治疗。相关成果发表于Small(DOI: 10.1002/**ll.202000809)。本文第一作者是北京化工大学生命学院博士研究生潘雪婷和**举。
近年来,由于光疗具有非侵入性、时间选择性和特定的空间性等优势,引起了研究人员的广泛关注。然而,复杂的肿瘤微环境限制了光疗剂在肿瘤部位的渗透深度从而阻碍了其治疗效率。为了克服肿瘤的生物学障碍,研究人员已经开发了许多提高治疗剂渗透性的创新策略。例如:可以通过紫外线等外源性或pH和特定酶等内源性**来改变治疗剂的物理性质(如尺寸、形态和表面电势),从而使其更深地穿透肿瘤。但是这些提高治疗剂渗透性的策略通常具有潜在的危害性或低的渗透效率,这阻碍了它们的实际生物应用。
针对以上难题,研究团队设计了一种具有光热和光动力性能的可降解纳米复合物(PRDCuS@AG),这种光疗剂具有细胞组织双重渗透能力,可以从一个细胞扩散到另一个细胞,并进一步安全渗透到肿瘤深部,从而提高了光疗剂的治疗效率。该纳米复合材料具有以下几个优势:1)PRDCuS@AG具有快速生物降解的能力。它可以在近红外光加速的基质金属蛋白酶9反应下生物降解为精氨酸修饰的小纳米颗粒(PRDCuS),从而在更深的肿瘤区域实现有效渗透;2)富含精氨酸的PRDCuS具有细胞组织双重渗透能力,可以进一步改善其在深部肿瘤组织中的积累。该研究团队发现,与未降解的PRDCuS@AG相比,被基质金属蛋白酶降解的PRDCuS@AG在多细胞肿瘤球模型中的扩散系数从3.82 × 10−3增至1.85 × 10−2 μm2 s−1;3)PRDCuS@AG具有优异的肿瘤双重光疗(光热治疗/光动力治疗)协同化疗效率,肿瘤抑制率约为97%;4)PRDCuS@AG最终可以降解为3 nm超小CuS纳米颗粒,可以有效地从尿液和粪便中排出,从而避免对正常组织的毒副作用。研究者相信,这种具有细胞组织双重渗透能力的可降解纳米复合物,可以有效地克服当前深层肿瘤治疗的局限性,为设计具有强肿瘤组织渗透能力的光疗剂提供了新的思路。
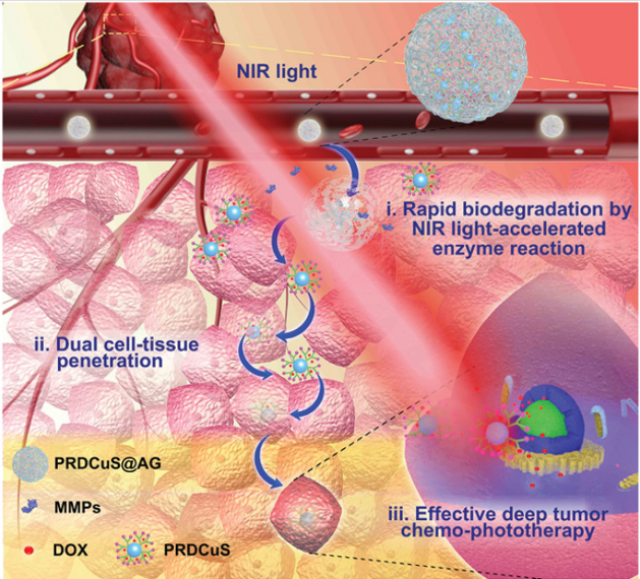
图1. PRDCuS@AG用于深部肿瘤化疗-光热治疗的示意图
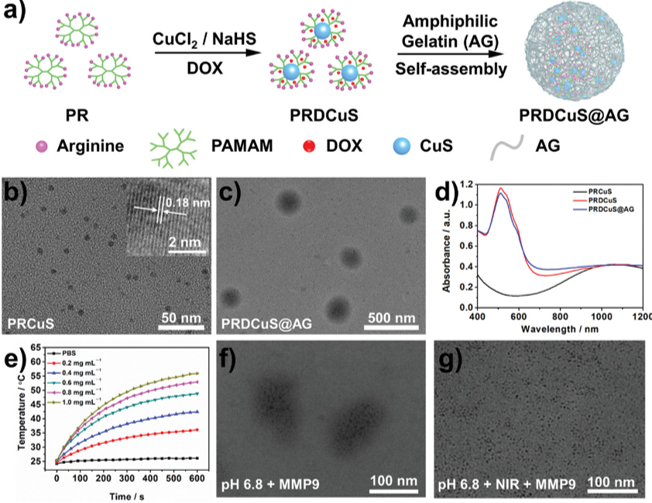
图2. PRDCuS@AG的制备、形貌表征、光热性能以及体外降解性能
要点:PRDCuS@AG由硫化铜(CuS)和装载阿霉素(DOX)的树枝状聚合物合成,其具有19.6%的光热转化效率,并可以在近红外光加速的基质金属蛋白酶9反应下快速降解。
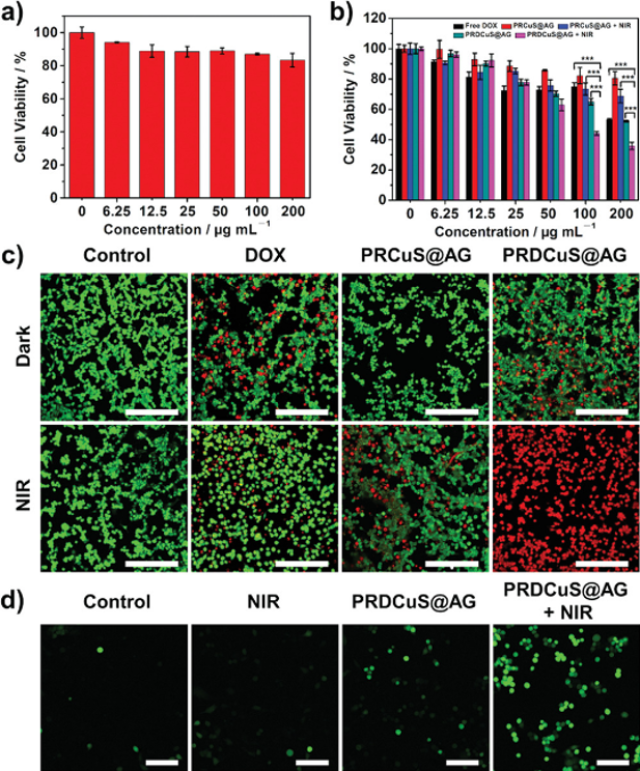
图3. PRDCuS@AG在细胞水平的化疗-光热治疗
要点:PRDCuS@AG具有良好的生物安全性。在激光照射下,能够有效地实现化疗/光疗协同治疗。
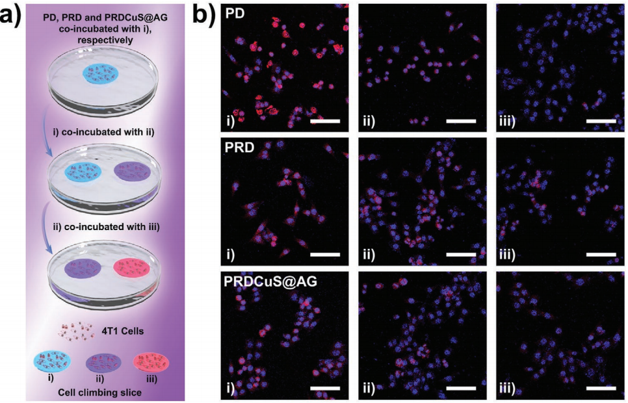
图4. PRDCuS@AG的胞内转移能力
要点:PRDCuS@AG可在胞内降解成富含精氨酸的PRDCuS,其具有从一个细胞扩散到另一个细胞的能力,从而增强深部肿瘤渗透。
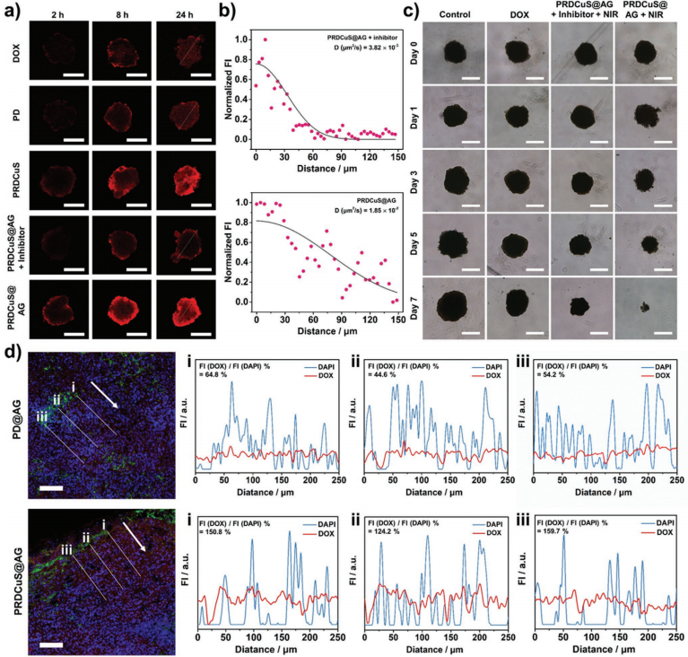
图5. PRDCuS@AG在多细胞肿瘤球和4T1皮下瘤模型中的渗透能力研究
要点:与未降解的PRDCuS@AG相比,被基质金属蛋白酶降解的PRDCuS@AG在多细胞肿瘤球模型中的扩散系数从3.82 × 10−3增至1.85 × 10−2 μm2 s−1;在4T1皮下瘤模型研究中,与PD@AG相比,PRDCuS@AG的渗透效率提高了166.4%。
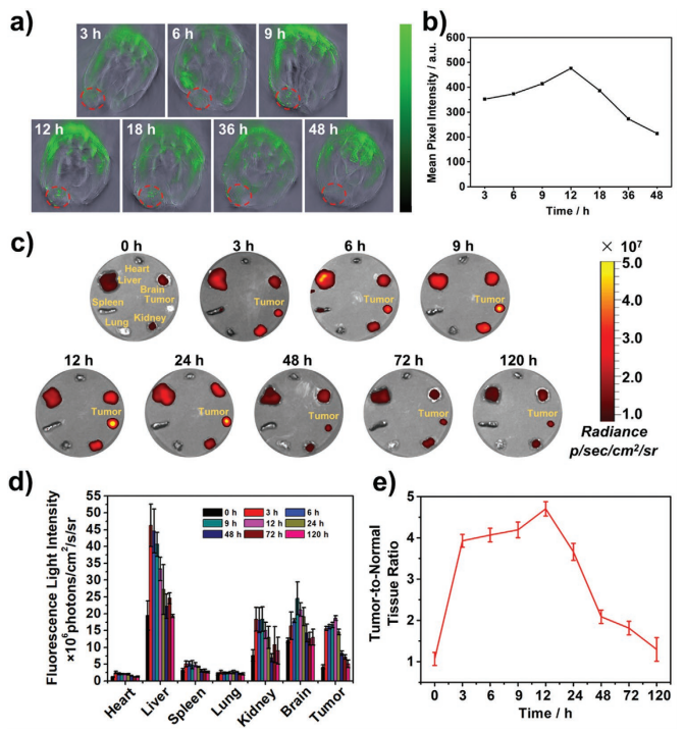
图6. PRDCuS@AG在体内的生物分布
要点:尾静脉注射后,PRDCuS@AG可在肿瘤部位逐渐累积并在12 h达到最大值。同时,随着时间的增加,PRDCuS@AG可逐渐排出体外。
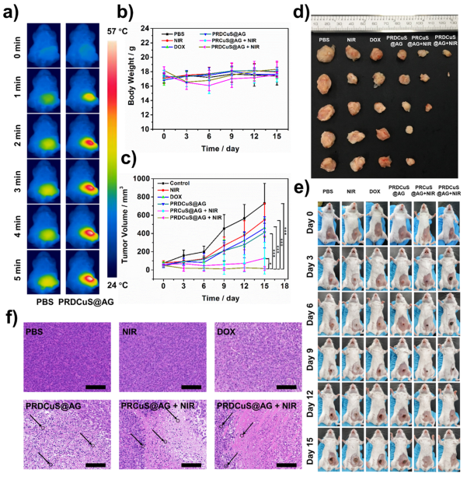
图7. PRDCuS@AG在体内的化疗-光热治疗效果评估
要点:激光照射下,PRDCuS@AG在4T1皮下瘤模型中实现了97.0%的肿瘤抑制率。所有动物实验均经中国人民***总医院动物伦理委员会批准。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/**ll.202000809
刘惠玉课题组网页:http://www.liuhuiyugroup.com
