近日,我室刘惠玉教授与中科院过程工程研究所魏炜研究员合作在《Advanced Materials》发表题为“Immunomodulation‐Enhanced Nanozyme‐Based Tumor Catalytic Therapy”的研究论文。该工作首次提出了一种基于免疫微环境调节的肿瘤催化治疗策略,通过免疫微环境调节与纳米酶催化活性作用间的协同,实现了肿瘤的高效治疗。本文第一作者是北京化工大学生命学院的博士研究生徐柏龙、硕士生崔妍和王伟伟博士。北京化工大学生命学院秦蒙副教授和软物质科学与工程高精尖创新中心刘桢教授提供了支持与帮助。
纳米酶是一种新型的人工模拟酶,其活性可调、稳定性高、易制备和成本低的优势使其在肿瘤催化治疗领域被不断发展。然而现阶段纳米酶的治疗效率仍然受肿瘤微环境诸多因素制约,如内源性过氧化氢含量不足、乏氧和免疫抑制性微环境等。因此,迫切需要发展更为高效的纳米酶基肿瘤催化治疗策略。
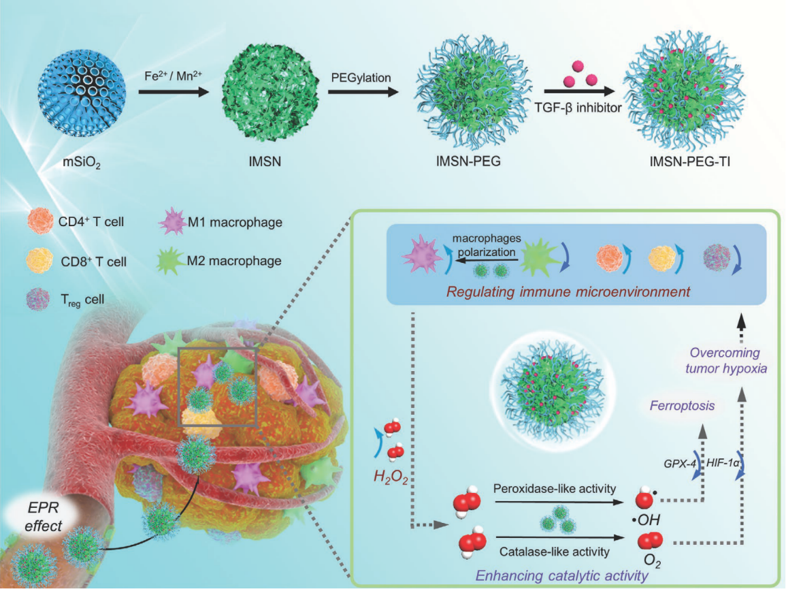
示意图1. 材料制备及治疗示意图
肿瘤微环境是一个复杂的体系,除肿瘤细胞外,肿瘤相关巨噬细胞(TAMs)等免疫细胞也存在于肿瘤微环境中。通常情况下,由于乏氧等条件的诱导,TAMs倾向于表达具有免疫抑制性的M2型巨噬细胞,而具有肿瘤杀伤性的M1型巨噬细胞较少表达。此外,研究报道M1型巨噬细胞的表达会潜在地提升瘤内过氧化氢浓度。因此,如果能利用纳米酶对肿瘤微环境进行重塑,将会实现纳米酶催化治疗和免疫调节的协同,提升肿瘤治疗效率。基于此,研究团队借助铁锰硅酸盐纳米酶-生长转化因子受体Ⅰ抑制剂(TGF-β抑制剂)复合体系(IMSN-PEG-TI),首次发展了一种免疫调节增强的纳米酶肿瘤催化治疗策略(示意图1)。该策略具有如下特点:
i) 纳米酶表现出双酶活性,即利用过氧化物酶活性产生具有肿瘤杀伤性的羟基自由基,利用过氧化氢酶活性产生氧气以缓解肿瘤乏氧;
ii) 纳米酶可与TGF-β抑制剂协同,共同调节免疫微环境,诱导M2型巨噬细胞极化为M1型巨噬细胞,从而提升瘤内H2O2浓度,增强纳米酶催化活性;
iii) 改善的免疫微环境和增强的纳米酶活性协同作用,最终实现了对荷瘤小鼠肿瘤87.5%的抑制率。我们相信该工作可为发展新型的纳米酶基肿瘤催化治疗策略提供新思路。
文章研究要点
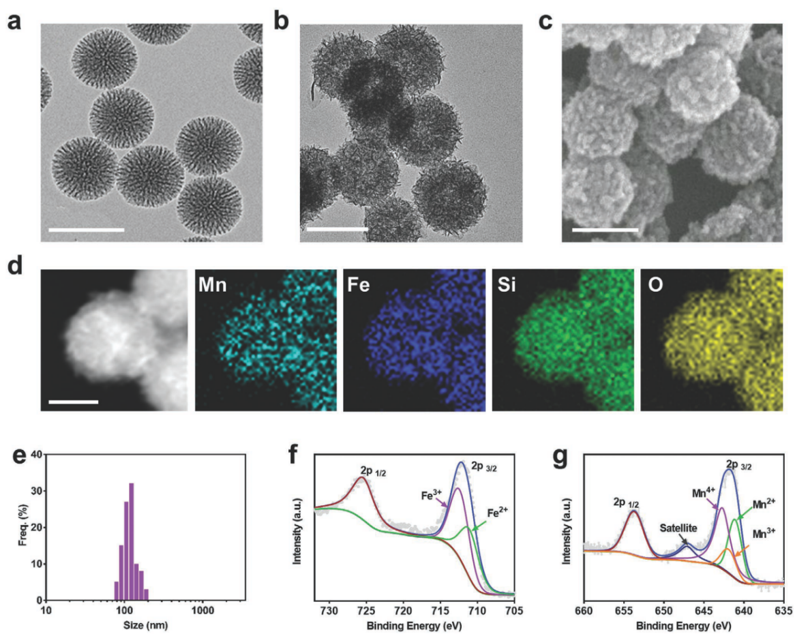
图1. 材料形貌及理化性质表征
i) 以树枝状介孔硅为模板,水热法合成粒径均一的铁锰硅酸盐纳米颗粒。元素mapping说明了Mn、Fe、Si和O元素的存在,XPS证实材料中金属元素以混合价态的形式存在。
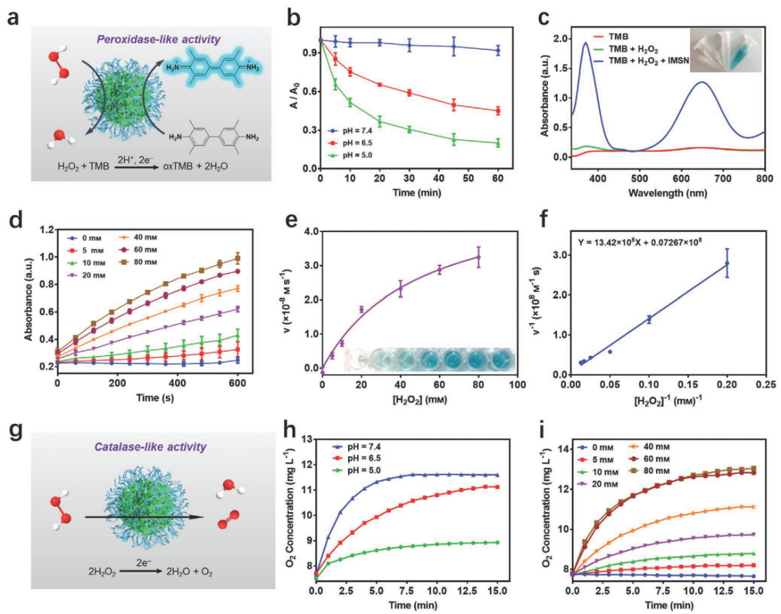
图2. 铁锰硅酸盐类过氧化物酶和过氧化氢酶活性表征
ii) 实验表明,具有混合金属价态的铁锰硅酸盐纳米颗粒在微酸性环境下具有较高的类过氧化物酶和过氧化氢酶活性,可有效地将过氧化氢分别分解转化为羟基自由基和氧气。
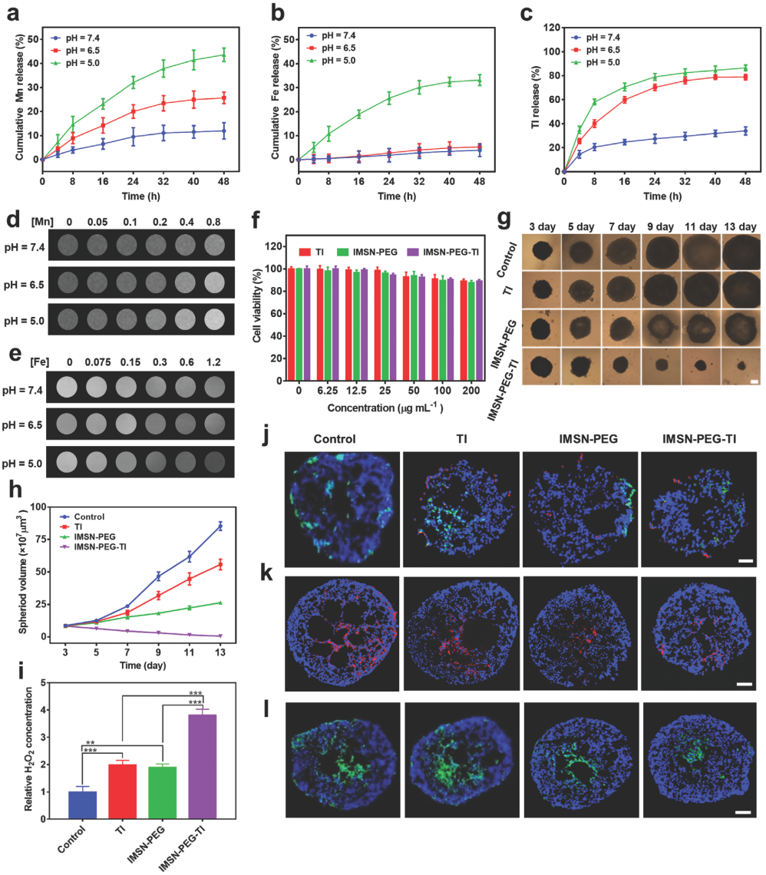
图3. 药物释放、MRI成像和3D细胞球治疗实验表征
iii) IMSN-PEG-TI具有pH响应性的金属离子和药物释放能力,同时其具有较好的MRI成像能力。3D细胞球实验和免疫荧光染色分析表明IMSN-PEG-TI可通过促进过氧化氢的产生和诱导巨噬细胞极化,抑制肿瘤细胞的生长(93.9%)并有效缓解肿瘤微环境的乏氧情况。
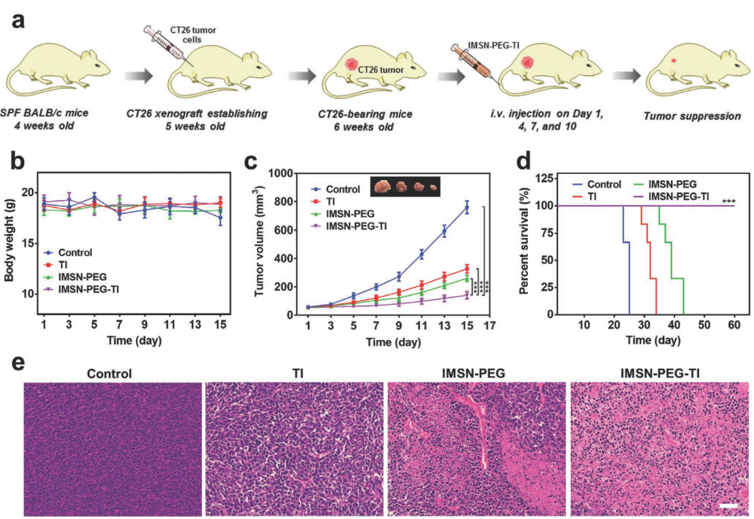
图4. 体内治疗实验
iv) 在CT26荷瘤小鼠模型中,与单独的纳米颗粒组IMSN-PEG和游离药物组TI相比,IMSN-PEG-TI表现出最高的治疗效率,对肿瘤的抑制率达87.5%,显著延长小鼠生存期,且对正常组织器官无明显损伤。
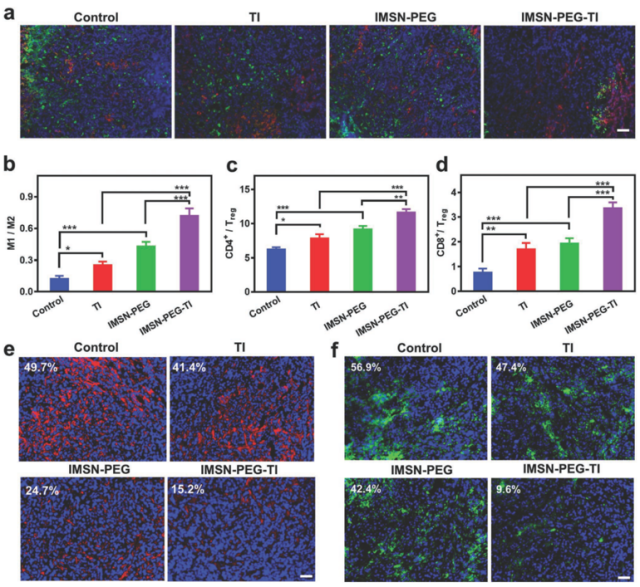
图5. 体内免疫微环境分析
v) 通过对免疫微环境分析,发现IMSN-PEG-TI可诱导巨噬细胞M2表型向M1表型极化,上调M1/M2, CD4+/Treg, CD8+/Treg的比例,并缓解肿瘤的乏氧情况,从而改善瘤内的免疫抑制性微环境。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202003563
刘惠玉课题组网页:http://www.liuhuiyugroup.com
